El sector de la biotecnología en Europa movió 5.489 millones de euros en el primer trimestre de 2020 y 4.811 millones en el segundo. En total, 10.300 millones de euros, un 9,5% más que en 2019. Ciertamente se trata de un sector muy fructífero, además de imprescindible, pero no por ello resulta un sector fácil de abordar en Europa.
Estamos asistiendo a continuos cambios en la UE que aumentan las dificultades de comercialización: el Brexit, ha hecho que el Reino Unido disponga de legislación propia y Suiza, por su parte, no ha renovado el acuerdo de colaboración que permitía comercializar un producto en su territorio igual que en la UE. Por ello ahora hay que cumplir nuevas normas para comercialización en esos países.
Sin embargo, estas dificultades legales que dependen de la pericia y conocimiento del fabricante o de disponer de una buena consultora especializada como deviCE Sistemas, no son infranqueables. Las verdaderas dificultades para un fabricante están ahora en las nuevas regulaciones europeas y en la falta de entidades que puedan evaluar su cumplimiento.
La situación en España del sector biotecnológico es similar: Según el informe publicado por AseBio en 2019 el sector biotecnológico ha generado una facturación de casi 12.000 millones de euros, un 1% del PIB. El 51% de estas empresas en España son micropymes, con menos de 10 trabajadores y el 45% son pymes y están distribuidas principalmente en Cataluña, Madrid, Andalucía y País Vasco. Las biotech lideran el ranking de crecimiento en producción con un 20,8% en el crecimiento y la productividad.

Las nuevas leyes y los Organismos Notificados
Con la entrada en vigor de la nueva legislación europea sobre productos sanitarios y productos sanitarios para diagnóstico in vitro, se han endurecido considerablemente los requisitos para la acreditación de los Organismos Notificados. Un Organismo Notificado (en adelante ON) es un organismo independiente que evalúa si un producto y empresa cumplen los requisitos legales que le aplican.
El pasado 26 de mayo de 2021 entró en aplicación la ley que hace referencia a la comercialización de los productos sanitarios en la Unión Europea, lo que coloquialmente se entiende como el Marcado CE de los productos sanitarios. Con esta ley todas las empresas fabricantes de productos sanitarios que por sus características se clasifican de “cierto riesgo”, han de ser evaluadas por un ON.
Esta situación, en principio, no difiere de lo que ocurría con las leyes derogadas, ya que con ellas también era requisito ser evaluado por un ON en esos casos. Sin embargo, el endurecimiento de los requisitos para la acreditación de un ON ha supuesto que el número actual de acreditados para evaluar productos bajo la nueva legislación sea ridículamente escaso para la demanda existente.
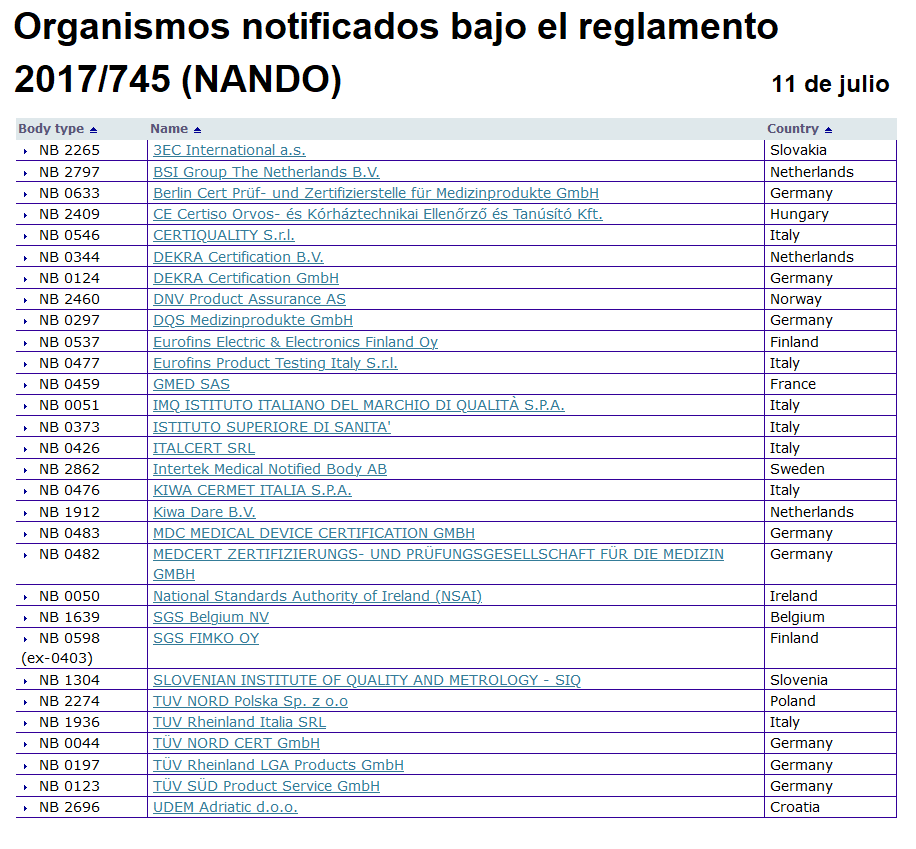

Estos ON deben atender actualmente a productos en tres situaciones de evaluación diferentes: Por una parte, todos los productos que ya disponían del visto bueno del ON conforme a las leyes anteriores para ser comercializados (certificación CE de conformidad), cuentan actualmente con una certificación caducada o a punto de caducar, lo que significa que todos estos productos deberán de ser evaluados nuevamente.
Por otra parte, muchos productos sanitarios que con la normativa anterior eran clasificados como productos de bajo riesgo (es decir, que podían ser “autocertificados” por el fabricante) se enfrentan ahora con una nueva normativa que los incluye entre los productos que necesitan ahora ser evaluados por un ON, esto sumado a todos aquellos productos sanitarios de nuevo desarrollo y que por sus características son considerados como productos que han de ser evaluados por un ON.
Teniendo en cuenta que asistimos a un cambio regulatorio, que las exigencias para la acreditación de entidades como ON son cada vez más exigentes, lo que ha supuesto la escasez de estos organismos certificadores, la realidad para la certificación CE de este tipo de productos, imperativa para su comercialización, se está haciendo cada vez más complicada.
Una empresa fabricante con un producto innovador y clasificado como de dificultad alta, es posible que no tenga más que uno o dos ON acreditados para evaluarle, lo que complica la certificación y comercialización.
El pasado 26 de mayo de 2022 entró en aplicación la ley europea sobre productos sanitarios para diagnóstico in vitro. Esto significa que todo lo que ya está ocurriendo para los productos sanitarios pasará, pero aumentado, con los dispositivos de diagnóstico in vitro. Si existen escasos ON para el producto sanitario, sorprendentemente, a día de hoy solo disponemos de 7 ON acreditados para dar servicio a todos los fabricantes de in vitro.
En definitiva, el sector de las biotecnológicas es un sector en alza, con gran impacto económico, en I+D y en conocimiento especializado. Pese a esto, las dificultades a las que están asistiendo estas empresas como consecuencia de los cambios regulatorios son notables y pueden suponer una desaceleración.
Euskadi es una de las zonas de España donde más se está desarrollando este sector, tanto en inversión de I+D como en conocimiento especializado. Muchas empresas han hecho un esfuerzo importante en el desarrollo de productos sanitarios e in vitro, pero este esfuerzo no se va a ver recompensado si no se facilitan los procesos regulatorios.
Existe una necesidad imperiosa de simplificar los procesos de evaluación de las entidades que quieran ser ON. Ciertamente la Comisión Europea ha hecho un esfuerzo importante permitiendo moratorias al cumplimiento de los requisitos legales de los productos in vitro, pero no es suficiente. La colaboración público-privada en Euskadi ha proporcionado sus frutos en el pasado y puede ser una herramienta muy interesante para el desarrollo de entidades especializadas que opten a ser ON en un proceso riguroso y exigente, pero ágil y rápido.








